PD-L1+肿瘤衍生的细胞外囊泡(TEVs)引起全身免疫抑制,并可能对抗PD-L1抗体(αPD-L1)封锁产生耐药性。然而,PD-L1+ TEVs是否以及如何介导αPD-L1治疗耐药尚不清楚。
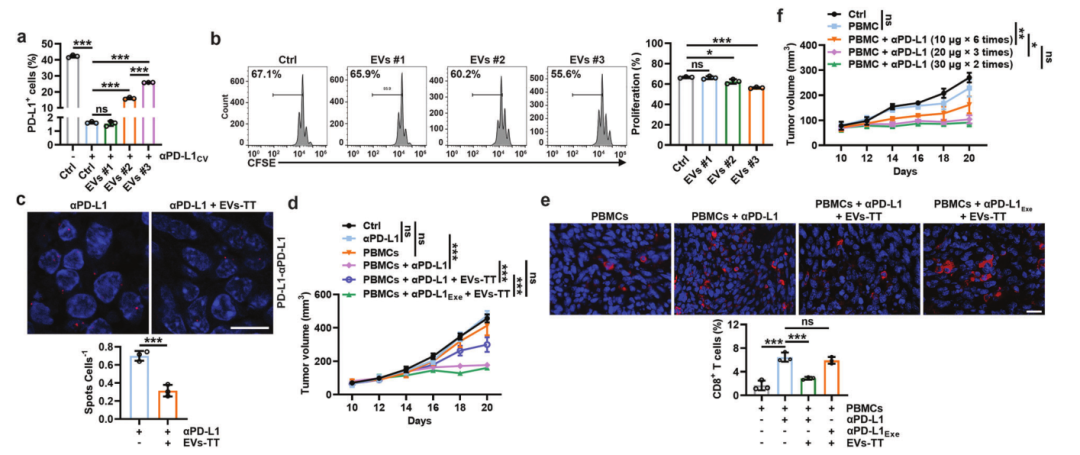
2022年10月11日,浙江大学蔡志坚团队在Cellular & Molecular Immunology(IF=22)在线发表题为“Tumor extracellular vesicles mediate anti-PD-L1 therapy resistance by decoying anti-PD-L1”的研究论文,该研究表明肿瘤细胞外囊泡通过诱骗抗PD-L1调节抗PD-L1治疗耐药性。该研究发现PD-L1+ TEVs在很大程度上诱骗了αPD-L1, TEVs结合的αPD-L1被巨噬细胞更快地清除,导致对肿瘤PD-L1的封锁不足和随后的αPD-L1治疗耐药。通过Rab27a或Coro1a敲除抑制内源性TEVs产生逆转αPD-L1治疗耐药。
临床药物pexidartinib介导的αPD-L1剂量增加或巨噬细胞减少均可消除αPD-L1治疗耐药。在αPD-L1治疗总剂量相同的治疗周期内,高剂量和低频治疗的抗肿瘤效果优于低剂量和高频治疗,诱导抗肿瘤免疫记忆更强,消除αPD-L1治疗耐药。值得注意的是,在人异种移植瘤人源免疫系统小鼠中,增加αPD-L1剂量和高、低频治疗均增强了αPD-L1的抗肿瘤作用。此外,增加αPD-L1和αPD-1的剂量具有相似的抗肿瘤作用,但αPD-L1扩增的PD-1+ Treg细胞较少,而PD-1+ Treg细胞是肿瘤高度进展的原因。总之,该研究结果揭示了TEVs介导的αPD-L1特异性耐药机制,从而为提高αPD-L1疗效提供了有前景的策略。
另外,2021年10月8日,浙江大学蔡志坚团队在Journal of Extracellular Vesicles(IF=26)在线发表题为“Neddylation of Coro1a determines the fate of multivesicular bodies and biogenesis of extracellular vesicles”的研究论文,该研究展示了 Coro1a 在 K233 处通过 TRIM4 进行了拟素化修饰(Neddylation)修饰。 拟素化的 Coro1a 与 MVB 膜相关,并通过直接结合 Rab7 促进 MVB 募集和 Rab7 的激活。随后,MVBs 靶向溶酶体以依赖 Rab7 的方式降解,导致 EV 分泌减少。此外,拟素化的Coro1a 的减少会增强肿瘤 EV 的产生,从而促进肿瘤进展,这表明拟素化的 Coro1a 是调节 EV 生物发生的理想靶标。总之,该研究数据确定了一种新的拟素化底物,并揭示了一种未知的 MVB 募集 Rab7 的机制,从而为 EV 生物发生的调控提供了新的见解。
免疫检查点封锁的应用,包括抗PD1和抗PD-L1抗体(αPD-1和αPD-L1),导致了肿瘤免疫治疗的重大革命。尽管αPD-1和αPDL1在各种肿瘤类型中表现出优异的疗效,即使在晚期肿瘤患者中,但由于原发性耐药,只有10-30%的患者对αPD-1和αPD-L1治疗有反应。此外,一些最初对αPD-1和αPD-L1治疗有反应的患者最终产生耐药,导致疾病进展。肿瘤细胞中β2-微球蛋白的丢失导致αPD-1-和α PD-L1治疗耐药。肿瘤细胞干扰素信号通路的缺陷也被认为是αPD-1和αPD-L1治疗耐药的潜在机制。然而,是否有不同的机制导致αPD-1和αPD-L1治疗耐药仍不清楚。
细胞外囊泡主要分为两类:外泌体和胞外小体。胞外小体(直径50-1000nm)是由质膜直接向外出芽产生的囊泡。外泌体(直径30-150nm)由内质体途径产生。TEVs含有大量来自其母细胞的蛋白质、核酸、脂质和代谢物,对细胞之间的通讯必不可少。PD-L1已被报道发生在肿瘤衍生EVs (TEVs)中,TEV PD-L1在诱导免疫逃逸中发挥核心作用。黑色素瘤衍生EVs上的PD-L1抑制CD8+ T细胞的激活,促进肿瘤生长。TEV PD-L1诱导全身免疫抑制,似乎对αPD-L1治疗具有耐药性。
TEV PD-L1与免疫治疗耐药有关,抑制TEV分泌可显著提高αPD-L1在4T1乳腺肿瘤模型中的治疗效果。这些结果表明,TEV PD-L1可能与αPD-L1治疗的耐药有关。然而,TEV PD-L1介导的具体耐药机制尚不清楚。两种分泌的PD-L1剪接变体缺乏跨膜结构域,已被证明可作为αPD-L1的“诱饵”,从而导致αPD-L1治疗耐药性。同样,除了通过在T细胞上结合PD-1转导抑制性信号传导外,TEV PD-L1是否也可能诱导αPD-L1,导致αPD-L1的消耗和随后的治疗耐药性,目前尚不清楚。
 PD-1有两个自然存在的配体PD-L1和PD-L2,通过PD-1向T细胞提供抑制信号。αPD-1阻断PD-L1和PD-L2共同触发的抑制信号,而αPD-L1仅阻断PD-L1介导的免疫抑制。理论上,αPD-1的抗肿瘤作用有望优于αPD-L1。但目前尚无αPD-1和αPD-L1在肿瘤治疗中的作用比较的原则性证明研究。此外,还没有指标来预测αPD-1或αPD-L1治疗对患者的益处更大。循环TEV PD-L1随着肿瘤进展而增加,消耗大量αPD-L1,但不消耗αPD-1。因此,TEV PD-L1可能会削弱αPD-L1的治疗效果,循环TEV PDL1可能是预测αPD-1和αPD-L1治疗效果的有效指标,但这一指标还有待进一步研究。
该研究发现TEVs可以通过PDL1有效地诱骗αPD-L1。TEV结合的αPD-L1更容易被巨噬细胞吞噬,然后更容易被溶酶体降解。这样,TEVs大量消耗αPD-L1,导致αPD-L1不足以阻断肿瘤细胞上的PD-L1,从而介导αPD-L1治疗耐药。
原文链接:
https://www.nature.com/articles/s41423-022-00926-6
版权声明
图文来源:iNature,版权属于原作者,仅用于学术分享
PD-1有两个自然存在的配体PD-L1和PD-L2,通过PD-1向T细胞提供抑制信号。αPD-1阻断PD-L1和PD-L2共同触发的抑制信号,而αPD-L1仅阻断PD-L1介导的免疫抑制。理论上,αPD-1的抗肿瘤作用有望优于αPD-L1。但目前尚无αPD-1和αPD-L1在肿瘤治疗中的作用比较的原则性证明研究。此外,还没有指标来预测αPD-1或αPD-L1治疗对患者的益处更大。循环TEV PD-L1随着肿瘤进展而增加,消耗大量αPD-L1,但不消耗αPD-1。因此,TEV PD-L1可能会削弱αPD-L1的治疗效果,循环TEV PDL1可能是预测αPD-1和αPD-L1治疗效果的有效指标,但这一指标还有待进一步研究。
该研究发现TEVs可以通过PDL1有效地诱骗αPD-L1。TEV结合的αPD-L1更容易被巨噬细胞吞噬,然后更容易被溶酶体降解。这样,TEVs大量消耗αPD-L1,导致αPD-L1不足以阻断肿瘤细胞上的PD-L1,从而介导αPD-L1治疗耐药。
原文链接:
https://www.nature.com/articles/s41423-022-00926-6
版权声明
图文来源:iNature,版权属于原作者,仅用于学术分享 |