南科大生物系黄鸿达课题组发表VASH2-SVBP进行微管去酪氨酸化分子机制研究成果
 近日,南方科技大学生物系副教授黄鸿达课题组在Nature Structural & Molecular Biology杂志上发表了最新研究成果,从结构上阐明了VASH2-SVBP蛋白复合物进行微管蛋白去酪氨酸化的分子机制。
微管蛋白的“酪氨酸化-去酪氨酸化”循环在进化上非常保守,对于微管正常行使其多样性的功能起到关键的作用。研究发现,在稳定性高的微管中去酪氨酸化的微管蛋白含量较多,而在动态变化的微管中则相反。微管蛋白“酪氨酸化-去酪氨酸化”循环的失调将会导致微管功能的紊乱,甚至会导致例如心脏衰竭、大脑发育障碍、癌症等一系列疾病的发生。
近日,南方科技大学生物系副教授黄鸿达课题组在Nature Structural & Molecular Biology杂志上发表了最新研究成果,从结构上阐明了VASH2-SVBP蛋白复合物进行微管蛋白去酪氨酸化的分子机制。
微管蛋白的“酪氨酸化-去酪氨酸化”循环在进化上非常保守,对于微管正常行使其多样性的功能起到关键的作用。研究发现,在稳定性高的微管中去酪氨酸化的微管蛋白含量较多,而在动态变化的微管中则相反。微管蛋白“酪氨酸化-去酪氨酸化”循环的失调将会导致微管功能的紊乱,甚至会导致例如心脏衰竭、大脑发育障碍、癌症等一系列疾病的发生。
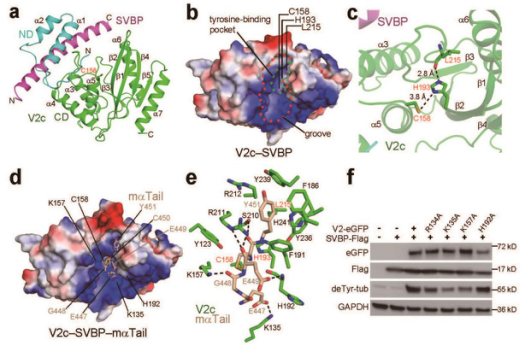 VASH2-SVBP的结构分析:(a) VASH2-SVBP复合物的整体结构(卡通模型),绿色为VASH2,紫色为SVBP蛋白;(b) VASH2-SVBP(显示为静电表面模式),酪氨酸结合口袋使用绿色虚线圈标出,结合口袋周围的静电沟槽使用红色虚线圈标出;(c) 催化三联体使用绿色棍棒模型标注,催化三联体之间的距离使用黑色虚线标出;(d) VASH2-SVBP(显示为静电表面模式)和a微管蛋白C末端小肽(显示为球棍模型)的复合物结构;(e) VASH2-SVBP和a微管蛋白C末端小肽的相互作用;(f) 检测VASH2关键氨基酸突变体的催化活性
起始微管蛋白“酪氨酸化-去酪氨酸化”循环的是微管蛋白酪氨酸羧肽酶,而最新的研究发现在哺乳动物中VASH1或VASH2两个同源蛋白和其辅助因子SVBP形成的异二聚体可以行使该羧肽酶功能。但是该羧肽酶如何催化微管蛋白去酪氨酸化的分子机理此前尚不清楚。
在此项研究中,生物系黄鸿达课题组博士后汪娜等解析了VASH2-SVBP复合物的晶体结构,并且通过生化和细胞实验证明SVBP不仅能够帮助VASH2进行正确的表达和折叠,而且对于VASH2进行a-微管蛋白C末端去酪氨酸化的功能也起到至关重要的作用。团队还获得了VASH2-SVBP与两种抑制剂(epoY和TPCK)的复合物晶体结构,阐明了这些抑制剂的抑制机理。此后,团队进一步解析了VASH2-SVBP与a-微管蛋白C末端的复合物晶体结构,揭示了VASH2-SVBP与a-微管蛋白C末端的结合模式,并结合生化实验和神经细胞发育实验揭示了VASH2-SVBP与微管纤维的相互作用界面。研究成果阐明了VASH2-SVBP进行a-微管蛋白C末端去酪氨酸化的结构基础以及其在神经细胞发育中的重要作用,为今后小分子抑制剂的研发提供了结构基础。
VASH2-SVBP的结构分析:(a) VASH2-SVBP复合物的整体结构(卡通模型),绿色为VASH2,紫色为SVBP蛋白;(b) VASH2-SVBP(显示为静电表面模式),酪氨酸结合口袋使用绿色虚线圈标出,结合口袋周围的静电沟槽使用红色虚线圈标出;(c) 催化三联体使用绿色棍棒模型标注,催化三联体之间的距离使用黑色虚线标出;(d) VASH2-SVBP(显示为静电表面模式)和a微管蛋白C末端小肽(显示为球棍模型)的复合物结构;(e) VASH2-SVBP和a微管蛋白C末端小肽的相互作用;(f) 检测VASH2关键氨基酸突变体的催化活性
起始微管蛋白“酪氨酸化-去酪氨酸化”循环的是微管蛋白酪氨酸羧肽酶,而最新的研究发现在哺乳动物中VASH1或VASH2两个同源蛋白和其辅助因子SVBP形成的异二聚体可以行使该羧肽酶功能。但是该羧肽酶如何催化微管蛋白去酪氨酸化的分子机理此前尚不清楚。
在此项研究中,生物系黄鸿达课题组博士后汪娜等解析了VASH2-SVBP复合物的晶体结构,并且通过生化和细胞实验证明SVBP不仅能够帮助VASH2进行正确的表达和折叠,而且对于VASH2进行a-微管蛋白C末端去酪氨酸化的功能也起到至关重要的作用。团队还获得了VASH2-SVBP与两种抑制剂(epoY和TPCK)的复合物晶体结构,阐明了这些抑制剂的抑制机理。此后,团队进一步解析了VASH2-SVBP与a-微管蛋白C末端的复合物晶体结构,揭示了VASH2-SVBP与a-微管蛋白C末端的结合模式,并结合生化实验和神经细胞发育实验揭示了VASH2-SVBP与微管纤维的相互作用界面。研究成果阐明了VASH2-SVBP进行a-微管蛋白C末端去酪氨酸化的结构基础以及其在神经细胞发育中的重要作用,为今后小分子抑制剂的研发提供了结构基础。
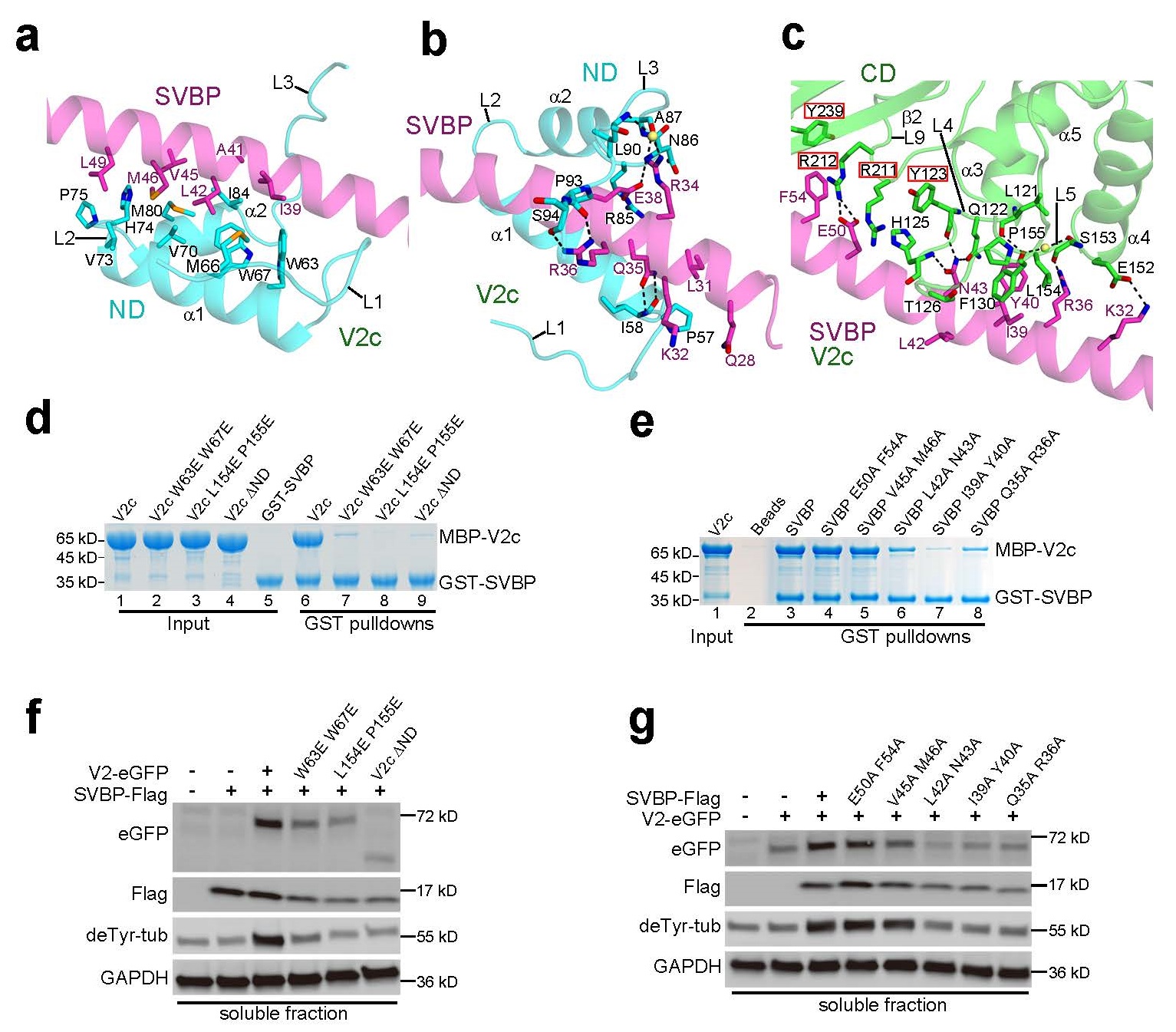 VASH2与SVBP的相互作用分析. (a-c) VASH2与SVBP的相互作用细节,复合物的整体结构为卡通模型,参与相互作用的氨基酸为棍棒模型,绿色为VASH2的C端结构域(CD),蓝色为VASH2的N端结构域(ND),紫色为SVBP蛋白;(d) GST-pulldown实验验证VASH2上参与VASH2与SVBP的结合的关键氨基酸,以及VASH N端结构域对VASH和SVBP的相互作用的影响;(e) GST-pulldown实验验证SVBP上参与VASH2与SVBP的结合的关键氨基酸;(f) 检测VASH2上N端结构域以缺失及关键氨基酸突变体的催化活性;(g) 检测SVBP上关键氨基酸突变体的催化活性
该项研究由黄鸿达课题组与Grenoble Institut Neurosciences的Marie-Jo Moutin博士以及瑞士Paul Scherrer Institut的Michel O. Steinmetz教授团队合作完成。南方科技大学生物系为第一通讯单位,黄鸿达课题组博士后汪娜为该文章的共同第一作者。
(论文链接:https://www.nature.com/articles/s41594-019-0241-y)
近期,黄鸿达课题组还和中国科学技术大学生命学院教授许超课题组等合作,揭示了VASH1-SVBP进行微管蛋白C末端去酪氨酸化的结构基础,以及VASH1-SVBP在细胞分裂中的重要作用。汪娜为该文章的共同第一作者。该研究论文近日在Cell Research杂志在线发表。
(论文链接:www.nature.com/articles/s41422-019-0187-y)。
两项研究的所有晶体数据均采集于上海光源19U/18U/17U线站。研究得到了国家科技攻关计划,中组部国家特聘专家(青年项目),深圳市孔雀计划B类的支持。
VASH2与SVBP的相互作用分析. (a-c) VASH2与SVBP的相互作用细节,复合物的整体结构为卡通模型,参与相互作用的氨基酸为棍棒模型,绿色为VASH2的C端结构域(CD),蓝色为VASH2的N端结构域(ND),紫色为SVBP蛋白;(d) GST-pulldown实验验证VASH2上参与VASH2与SVBP的结合的关键氨基酸,以及VASH N端结构域对VASH和SVBP的相互作用的影响;(e) GST-pulldown实验验证SVBP上参与VASH2与SVBP的结合的关键氨基酸;(f) 检测VASH2上N端结构域以缺失及关键氨基酸突变体的催化活性;(g) 检测SVBP上关键氨基酸突变体的催化活性
该项研究由黄鸿达课题组与Grenoble Institut Neurosciences的Marie-Jo Moutin博士以及瑞士Paul Scherrer Institut的Michel O. Steinmetz教授团队合作完成。南方科技大学生物系为第一通讯单位,黄鸿达课题组博士后汪娜为该文章的共同第一作者。
(论文链接:https://www.nature.com/articles/s41594-019-0241-y)
近期,黄鸿达课题组还和中国科学技术大学生命学院教授许超课题组等合作,揭示了VASH1-SVBP进行微管蛋白C末端去酪氨酸化的结构基础,以及VASH1-SVBP在细胞分裂中的重要作用。汪娜为该文章的共同第一作者。该研究论文近日在Cell Research杂志在线发表。
(论文链接:www.nature.com/articles/s41422-019-0187-y)。
两项研究的所有晶体数据均采集于上海光源19U/18U/17U线站。研究得到了国家科技攻关计划,中组部国家特聘专家(青年项目),深圳市孔雀计划B类的支持。
来源:南方科技大学 新闻网
|